差示扫描量热法 (DSC)
蛋白质稳定性的可靠鉴定

蛋白质稳定性的可靠鉴定

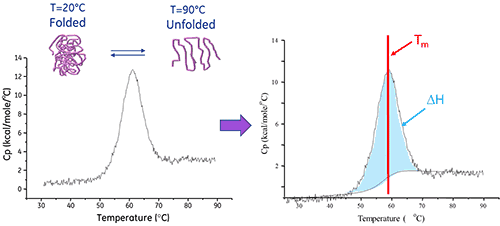
差示扫描量热法 (DSC) 是一种分析技术,用于直接鉴定蛋白质或其他生物分子原生形态的稳定性。该技术通过测量与分子恒速加热时热变性相关的热量变化予以实现。
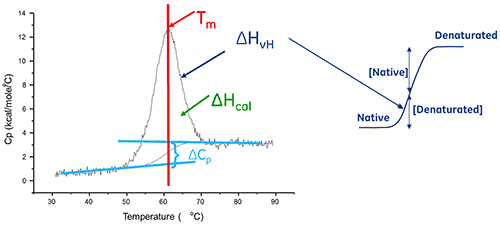
溶液中的生物分子在其自然(折叠)和变性(展开)构象之间保持平衡。热跃迁中点 (Tm) 越高,分子越稳定。DSC 可测量因热变性造成的去折叠热焓 (∆H)。它也被用于确定变性过程中的热容变化 (ΔCp)。DSC 可以说明有助于原生生物分子折叠和保持稳定的因素。这些因素包括疏水相互作用、氢键结合、构象熵和物理环境。
从 DSC 获得的精确且高质量的数据,可提供有关蛋白质在工艺开发过程中和潜在候选治疗药物配制过程中的稳定性的重要信息。
大分子和大分子组合体(>5000 道尔顿),如蛋白质、核酸和脂类,可形成经过热诱导构象变化的清晰结构。这些结构重组的结果是,非共价键重新分配导致热吸收。差示扫描量热仪可测量这种热摄取。
DSC 系统的热核心包括两个池,一个参比池和一个样品池。
从设计角度来看,该装置可使这两个池在加热期间保持相同的温度。
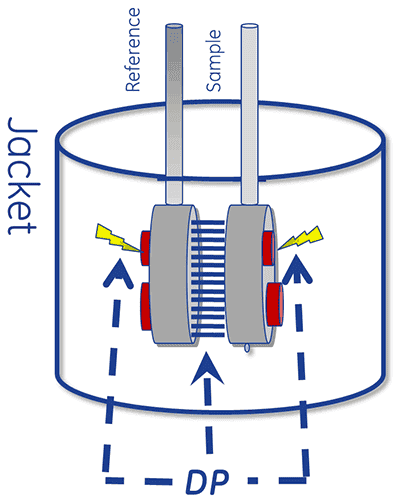
如需进行 DSC 测量,首先要向参比池中注入缓冲液,同时向样品池中注入样品溶液。然后以恒定的扫描速率对其进行加热。
当蛋白质展开导致两池之间有温差 (ΔT) 时就会发生热吸收,从而在整个珀耳帖单元内形成热梯度。这就形成了电压,该电压将会转换为电力,用于控制珀耳帖将 ΔT(温差)恢复为 0°C。或者,两池可通过热传导被动实现热平衡。
蛋白质展开状态的热焓是浓度正态化 DSC 峰下的面积,并且每摩尔有多个热量单位(或焦耳)。
在某些情况下,可使用热力学模型拟合数据,以获得吉布斯自由能 (Δg)、量热焓 (Δhcal)、范特霍夫焓cal)、范特霍夫焓 (ΔHvH)、熵 (ΔS) 和与跃迁相关的热容变化 (ΔCp)。
差示扫描量热法分析广泛用于药物发现和开发。主要应用包括:

PEAQ-DSC Automated适用于法规监管环境下的生物分子稳定性分析 |

PEAQ-DSC适用于法规监管环境下的生物分子稳定性分析 |
|
|---|---|---|
| 测量类型 | ||
| 无标记分析 | ||
| 蛋白质稳定性 | ||
| 技术类型 | ||
| 差示扫描量热法 (DSC) | ||
| 通量 | ||
| 温度范围 | ||