脂质体是指由双层脂质分子构成的囊,形成一个封闭的水性内部结构 [1]。
它们最初用作模型系统,以研究薄膜特性,如渗透性[2]。 由于其内部的水性核可以溶解水性物质,膜结构可以溶解油溶性物质 [3-5],近期的应用均集中在其作为施药载体的作用方面。 通过抗体或肽的接合 [6-8] 控制脂质构成或表面修饰,脂质体可专为特定应用而设计。 例如,阴离子脂质体可以与 DNA混合,因此可用于基因治疗 [9, 10]。
静脉注射脂质体的命运是由多种特性决定的。 其中两个最重要的属性便是粒度和 Zeta 电位。 脂质体的作用部位 —细胞在体内的相互作用主要由粒度决定。 小的脂质体可以穿过肝窦的膜孔。 中等大小的脂质体被保留在血腔,可以循环很久。 更大的脂质体则被枯否细胞迅速移除。 这两个参数都可以使用 Zetasizer Nano 系列仪器测量。 使用动态光散射(DLS)测量粒度。 由于颗粒处于布朗运动之下,散射光强度会随着时间推移发生波动。该技术正是用于测量该波动。 分析这些强度波动可以得到颗粒的扩散系数并转化为粒度大小和分布。
颗粒的 Zeta 电位是指颗粒在特定介质中获得的总体电荷。 了解脂质体制备的 Zeta 电位有助于预测生物体内的脂质体性能。在基因治疗中,Zeta 电位用来优化脂质体同DNA质粒的比例,减少团聚。 使用激光多普勒电泳测量样品的 Zeta 电位。 有关该技术的更多信息请访问马尔文仪器网站上的其它应用和技术报告。
本应用报告总结了对阴离子和阳离子脂质体进行的粒度和 Zeta 电位测试。
采用声波降解法制备脂质体 [1]。 从二棕榈酰磷脂酰胆碱(DPPC)和磷酸盐缓冲液(PBS)中的二棕榈酸磷脂酰甘油(DPPG)的各种混合制备一系列阴离子脂质体,详见表 1。 阴离子脂质体由 DPPC、胆固醇和阴离子表面活性剂双十八烷基二甲基溴化铵(DDAB)制备而成,详见表2。 在所有情况下,脂质体的最终浓度均为4mg lipid/ml PBS。
| DPPC (mg) | DPPG (mg) | DPPG (mole %) | PBS (ml) |
|---|---|---|---|
| 19 | 1 | 5.2 | 5 |
| 18 | 2 | 10.9 | 5 |
| 17 | 3 | 17.4 | 5 |
| 16 | 4 | 24.6. | 5 |
| 15 | 5 | 32.8 | 5 |
| DPPC (mg) | 胆固醇(mg) | DDAB (mg) | DDAB (mole %) | PBS (ml) |
|---|---|---|---|---|
| 17 | {2}. | 1 | 5.6 | 5 |
| 16 | {2}. | {2}. | 11.8 | 5 |
| 15 | {2}. | 3 | 18.6 | 5 |
| 14 | {2}. | 4 | 26.1 | 5 |
| 13 | {2}. | 5 | 34.6 | 5 |
在氯仿中溶解和混合脂质体(DPPG 溶解在由氯仿和甲醇以2:1 v/v 的比例混合的溶液中),在 60°C 下通过旋转蒸发清除溶剂,从而获得一层脂质薄膜。 添加适当体积的磷酸盐缓冲液(在 60°C 下预热),剧烈摇动容器,从而生成多层囊(MLV)。 然后在 60°C 下对MLV 进行超声波降解,持续 15 分钟,以生成单层脂质体。 在超声波降解后,脂质体样品在 60°C 下保存 15 分钟,以便样品韧化[1]。
采用 Zetasizer Nano 在 25°C 下完成所有粒径和 Zeta 电位测量。 粒径测量在干净的脂质体样品上完成,使用 PBS 以 1:10 的比例稀释样品,然后进行 Zeta 电位测量。 Nano ZS 结合了非侵入式背侧散射(NIBSTM)光学元件,用于粒径测量。 173° 的探测角度确保可对浓缩的、混浊样品进行粒度测量。 但是,在Zeta 电位测量过程中,样品发出的散射光在向前12° 被检测。 因此,激光束需要穿透样品,为此,Zeta 电位测量的样品浓度必须低于粒径检测的浓度。
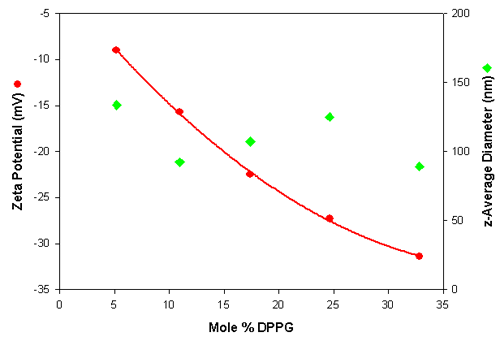
各种阴离子脂质体的粒度和 Zeta 电位测量的结果请见表 3。 该表格显示了各种脂质体样品的 Z 平均直径(根据散射光强度的平均直径)、多分散指数(分布宽度的预测值)和平均 Zeta 电位值。 Z 平均直径值是对干净的脂质体样品重复进行三次测量(标准偏差见括号内所示)得到的平均值。 Zeta 电位值是对稀释的样品(以 1:10 的 PBS 稀释)重复进行五次测量(标准偏差见括号内所示)得到的平均值。
| 摩尔% DPPG | z-平均直径(单位:nm) (SD) | 多分散性 (SD) | Zeta 电位(单位:mV) (SD) |
|---|---|---|---|
| 5.2 | 133.8 (0.4) | 0.292 (0.03) | 9.0 (0.64) |
| 10.9 | 92.3 (0.49) | 0.269 (0.01) | >15.7 (1.36) |
| 17.4 | 107.2 (0.20) | 0.256 (0.01) | 22.5 (0.95) |
| 24.6 | 125.1 (0.60) | 0.261 (0.01) | >27.3 (1.29) |
| 32.8 | 89.2 (1.39) | 0.264 (0.01) | 31.4 (0.98) |
这些阴离子脂质体制备获得的粒径结果表明,使用槽式声波降解法进行制备可提供相似的粒度平均值和分布宽度。
Zeta 电位和粒度值以摩尔% DPPG 的函数表示,详见图1绘制。 该数据表明,每个脂质体样品的测量均可重复,其显示了随着 DPPG 含量提高,样品带有更多负电荷的趋势。 此外,该结果表明,粒度与脂质体的构成无关。
|
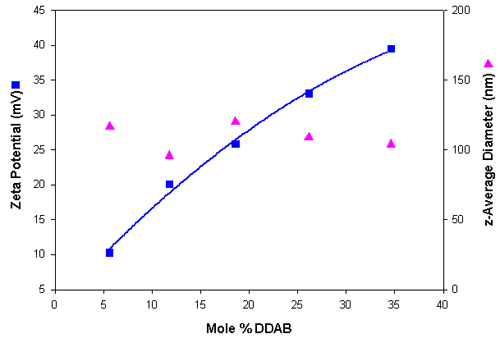
表4 总结了从一系列阳离子脂质体中获得的粒度和 Zeta 电位结果。 与阴离子脂质体制备过程相比,该结果显示了相似的粒度分布信息。 图 2 显示了以依赖于DDAB的 Zeta 电位和粒度结果图,说明随着脂质体中 DDAB 含量的提高,正电荷逐渐增加。
|
| 摩尔 % DDAB | z-平均直径(单位:nm) (SD) | 多分散性 (SD) | Zeta 电位(单位:mV) (SD) |
|---|---|---|---|
| 5.6 | 116.6 (1.0) | 0.258 (0.01) | 10.3 (0.88) |
| 11.8 | 95.8 (0.36) | 0.223 (0.01) | 20.1 (1.36) |
| 18.6 | 120.3 (0.40) | 0.266 (0.01) | 25.9 (0.52) |
| 26.1 | 109.0 (1.15) | 0.270 (0.01) | 33.1 (2.2) |
| 34.6 | 104.0 (0.42) | 0.251 (0.01) | 39.5 (1.2) |
脂质体的物理表征对于了解其在各种应用中的适用性极其重要。 了解脂质体制备的 Zeta 电位有助于预测脂质体在生物体内的脂质体命运。 带电脂质体与带相反电荷的分子的结合性可通过测量合成的复合体之Zeta 电位进行监控。
如本应用报告详述,Zetasizer Nano 系列可快速、重复地表征脂质体的粒度和Zeta 电位。
[1] New, R.R.C. (1992) in Liposomes: A Practical Approach, IRL Press, Oxford, UK.
[2] Bangham, A.D., Hill, A.W. and Miller, N.G.A. (1974) in Methods in Membrane Biology, vol. 1, pp 1-68, Plenum Press, New York.
[3] Schmidt, K.H. (ed.) (1986) in Liposomes as Drug Carriers, Verlag, Stuttgart and New York.
[4] Knight, G. (ed.) (1981) in Liposomes: From Physical Structure to Therapeutic Applications, Elsevier/North Holland Biomedical Press, Amsterdam.
[5] Gregoriadis, G. (1988) in Liposomes as Drug Carriers: Recent Trends and Progress, John Wiley and Sons, Chichester, UK.
[6] Hutchinson, F.J., Francis, S.E., Lyle, I.G. and Jones, M.N. (1989) Biochim. Biophys. Acta 978, 17-24.
[7] Jones, M.N. and Kaszuba, M. (1994) Biochim. Biophys. Acta 1193, 48-54.
[8] Kaszuba, M., Lyle, I.G. and Jones, M.N. (1995) Colloids and Surfaces 4, 151-158.
[9] Pedroso De Lima, M.C., Simoes, S., Pires, S. Faneca, H. and Duzgunes, N. (2001) Adv. Drug Deliv. Rev. 47, 277-294.
[10] Eastman, S.J., Siegel, C., Tousignant, J., Smith, A.E., Cheng, S.H. and Scheule, R.K. (1997) Biochim. Biophys. Acta 1325, 41-62.