在此应用说明中,三重检测尺寸排阻色谱 (SEC-TD) 用于了解蛋白质形成有序规整结构复合物的能力。 这些蛋白质复合物背后的控制机制是我们了解蛋白质信号通路及其所控制的生理反应的基础。
蛋白质能够形成有序规整结构复合物对其生物学功能是至关重要的。 此类复合物可为同源寡聚体或异源寡聚体,能够控制诸如活性、稳定性和定位等不同属性。 了解这些复合物如何形成及其背后的控制机制,是我们了解蛋白质信号通路及其所控制的生理反应的基础。 在此领域中,我们最感兴趣的是病原微生物的毒力因子复合物如何装配。 此类微生物分泌这些毒力因子以促进寄主感染、病菌存活和定植,因此对发病起决定作用。 若能靶向并抑制此类毒力因子,即可开创抗菌治疗的新时代。 先决条件之一是了解导致异源和同源寡聚体的形成机制。 为了表征所选微生物毒力因子的蛋白质相互作用,我们联用了先进的光散射检测器与液相色谱法。
按照说明准备材料和蛋白质(参见参考文献 1、2、3、4)。
通过采用 SEC-TD,同时将尺寸排阻色谱 (SEC) 系统连接至一个三重检测器阵列 TDA (Malvern, UK) ,对特性粘度和分子量进行测定。 TDA 包含 (i) 一个静态光散射单元以及两个发光二极管检测器,小角 (LALS) 激光散射角度为 7°,直角激光散射角度为 90°,(ii) 一个示差折光率检测器,(iii) 一台光度计和 (iv) 一台示差粘度计。 使用光度计和折光率检测器确定蛋白浓度。 RALS 和 LALS 数据结合浓度,可得出分子量 M。 使用示差粘度计计算特性粘度 (η)。 使用 OmniSEC 软件计算分子量和特性粘度。
我们研究了细菌毒力因子蛋白复合物的构象和形成。 利用耦联三重检测器阵列的尺寸排阻色谱生成与这些蛋白质行为相关的关键信息,如下所述。
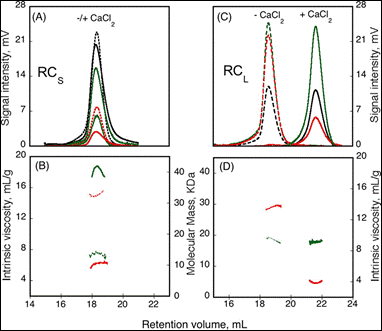
同源寡聚体的形成受多种因素控制。 在此研究了钙离子结合或存在调节肽时的影响。 由病原微生物分泌的多种毒力因子中存在“重复序列毒素” (RTX) 模体。 来自百日咳博代氏杆菌 (CyaA) 的钙依赖性腺苷酸环化酶毒素利用 RTX 重复结构域 (RD) 引发钙响应。 我们表征了两个 RD 亚域 RCS 和 RCL (2) 对 Ca2+ 结合的响应(图 1)。
|
基于直角散射数据(绿色曲线)和示差折光计(黑色曲线),可推断出 RCL 结构在 Apo (- Ca2+) 和 Holo (+ Ca2+) 形式下具有相同的分子量(图 1)。 然而,Apo 和 Holo 形式的保留体积存在差异,分别为 18 mL 和 22 mL,表明这种肽在与钙离子结合后具有更小的流体力学体积。 此外,结合钙离子还会导致特性粘度从 13.7 下降至 3.9 mL.g-1。 与 RCL 结构相比,钙离子与 RCS 结合不会改变保留体积,但是会导致分子量从 15.1 kDa 增加至 42 kDa,特性粘度从14.7 下降至 6.4 mL.g-1。 总之,这些数据表明与钙离子结合后,RCL 采取了更小的、结构紧密的单体构象,而 RCS 形成了结构紧密的三聚体,并且与不存在钙离子时可观察到未折叠的单体大小一致。
|
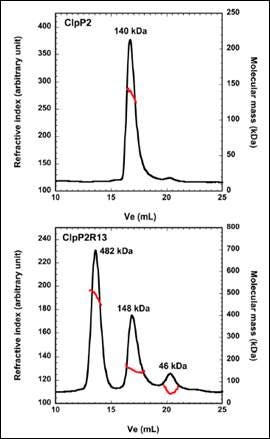
ClpP2 是一种 ATP 依赖性蛋白水解复合物,通常认为它能够促进结核分枝杆菌在寄主细胞吞噬体内多年保持休眠状态。 在活体内,ClpP2 形成一个十四聚体复合物,是充分发挥肽酶活性所必需的物质,但是该复合物的形成和控制机制仍然未知。 我们认为无序的 N 端肽序列可在调控中发挥作用。 因此,我们使用带三重检测的尺寸排阻色谱分析了野生型 ClpP2 和 N 端截短型的 ClpP2R13。 相关数据见图 2。 洗脱出的 ClpP2 形成一个单一主峰,分子量为 140 kDa。 这相当于六聚体和七聚体的结合体。 然而,去除 N-端前序列会导致 482kDa、148 kDa 和 46 kDa 处出现三个主峰。 分子量最大的种类对应于 21 聚体的同源寡聚体。 同时,这比预期的十四聚体大,这些数据表明 ClpP2 的前序列是形成高阶寡聚体的调控子。
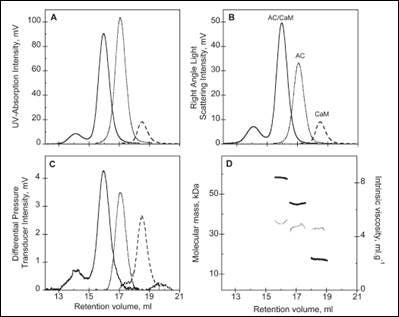
多种蛋白质的活性受到不同调控蛋白结合的控制,这些调控蛋白可以是催化剂或抑制剂。 在此借助 SEC-TD 研究了带有特殊调控蛋白的细菌毒力因子复合物。 CyaA 是百日咳博代氏杆菌(百日咳的病原体)的一种关键毒力因子。 与钙调蛋白 (CaM) 结合并激活后,CyaA 将诱发生成致病水平的 cAMP。
|
各组分和异源复合物的 SEC-TD 数据见图 3。 CaM-CyaA 催化结构域 (AC) 复合物的分子量经测定为 58.4 kDa,约等于单体的分子量总和(AC 和 CaM 的分子量分别为 43.8 kDa 和 17.2 kDa)。 这些数据充分表明该复合物包含 CaM 和 AC,化学计量比为 1:1,此结论得到了分析超速离心法 (AUC) 数据的支持(未显示)。 根据 SEC-TD 分析得到的特性粘度数据,AC、CaM 和 CaM-AC 复合物的特性粘度值分别为 5.2、4.9 和 5.0 mL.g-1。 CaM-AC 复合物数值较小表明在复合物形成时 CaM 和 AC 出现强烈压紧。 与上述结果一致的是,采用 AUC 测定的 CaM-AC 的流体动力学半径值为 3.3 nm 而不是预期的 3.7 nm(数据未显示)。 总之,这些数据表明 CaM 与 CyaA 结合后形成一个紧密的 1:1 异二聚体过程中存在一个信号通路。
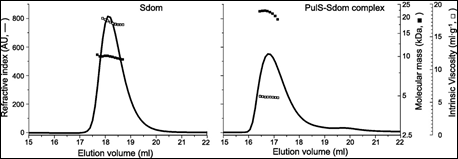
最后, 微生物产酸克雷伯菌的膜分泌素 PulD 是多聚体膜复合物的一种组分,可分泌足量的毒力因子以进入寄主体内。 为了正确定位至细菌膜,PulD 与伴侣蛋白 PulS 相结合。 使用 SEC-TD 研究 PulS 与 PulD (Sdom) 的 S 结构域之间的相互作用。 数据见图 4。
|
分子量测定确证了分子量为 22.1 kDa 的 Sdom:PulS 1:1 复合物的形成。 Sdom 和 Sdom:PulS 复合物的特性粘度数据分别为 16.9 和 5.9 mL.g-1。 这些数据与特性粘度值(Sdom 为 4.4,Sdom:PulS 为 2.5)结合充分表明 Sdom 形成了细长的无序结构,而 Sdom:PulS 复合物形成了紧实有序的结构。 这些数据受到流体力学半径值的支持,PulS 和 Sdom 的流体力学半径分别为 1.7 nm 和 2.5 nm,而 Sdom:PulS 复合物的流体力学半径仅为 2.7 nm。
蛋白信号通路一般比较复杂,涉及多种不同组分,通常涉及多蛋白信号复合物。 了解这些异源寡聚体和同源寡聚体背后的形成机制,对了解此类复合物的调控机制和活性至关重要。 此应用说明中所示的数据表明可使用 SEC-TD 系统获得令人信服的信息。 此类信息包括单体和复合物的分子量和大小以及蛋白质结构数据,极其有助于阐明这些多蛋白信号通路背后的机制和特征。
此应用说明中所包含的研究在下列出版物中做了进一步阐述:Biochem, (2010) Vol.49, p.318-328; J. Biol. Chem, (2011) Vol.286, p.16997-17004; J. Biol. Chem. (2011) Vol. 286, p.38833 – 38843; BMC Biochem (2011) Vol.12, Issue 61.