此处所述的工作说明了蛋白质表征的初期如何使用差示扫描量热法 (DSC) 快速提供有关蛋白质稳定性的关键数据,这些数据可用作支持和加速液体制剂的指南。
针对多种临床适应症,开展了单克隆抗体研发项目 (1,2)。 商用重组蛋白质(包括单克隆抗体)要研发成有效的生物药剂,除了生物活性,还需要其他特性。 它们尤其需要耐化学降解,且可在给定环境中保持物理稳定,同时没有发生聚合的倾向 (3,4)。 此外,它们需要有较长的血清半衰期,且不具有或几乎没有潜在的免疫原性 (5)。
除了比液体制剂的生产成本高,冻干药品 (DP) 必须由医生复原,对病人进行肠胃外给药前需要 10 到 20 分钟的时间。 促使生物制药业集中资源研发液体制剂而非传统冻干 DP 的主要原因是给药更简便。 然而,在液体制剂方面有一些技术问题需要克服。 主要挑战是通过最大程度提高物理稳定性和减少化学聚合保证蛋白质生物药剂在液体制剂中的稳定性。 研发用于皮下给药的生物药剂尤其具有挑战性,因为这种液体制剂应具有尽量高的蛋白质浓度,以补偿可能的注射量(1.0 ml 至 1.5 ml)带来的限制 (6)。
|
这给制剂研发团队带来了很大的压力,他们需要精心调配出最适合每种生物药剂的液体制剂。 重组蛋白质(尤其是单克隆抗体)的结构和稳定性分析非常重要,这也是研发生物药剂配方必不可少的条件。 很多可用于获得结构信息和蛋白质稳定性信息的方法都得到了发展。 DSC 成为研究蛋白质生物药剂稳定性的重要物理化学方法之一 (7-11)。 DSC 可以在不进行标记和使用人工探针的情况下快速研究蛋白质去折叠过程,该方法可在蛋白质去折叠时确定样品的吸热量,从而衡量其热稳定性以及指示其长期稳定性。
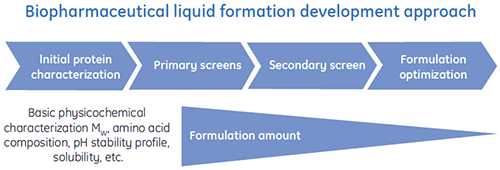
为了高效地研发出最佳的生物药剂配方,研发者们设计了专门的液体制剂研发程序。 图 1 显示了典型液体制剂研发过程的总体方案。
实践证明,DSC 在液体制剂研发的初期阶段尤其重要,在这个阶段,其可以快速减少尝试的制剂数量,从而节省原料药 (DS) 和在复杂的分析上花费的时间。
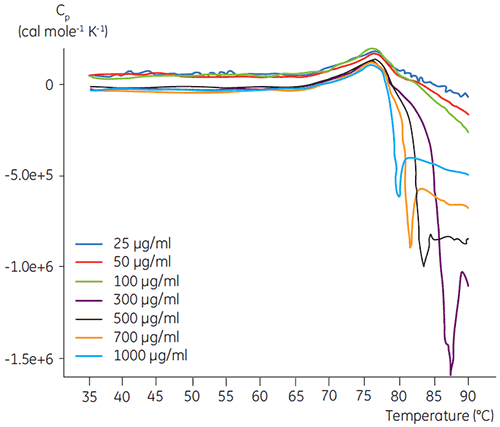
使用 Malvern MicroCal VP-DSC (Malvern Instruments) 进行 DSC 实验,扫描速率为 1.5 K/min。 样品在分析前脱气五分钟。 在所有实验中,热量计参比池中注入与样品缓冲液相一致的缓冲液。 从蛋白质扫描中扣除缓冲液基线,并在数据分析中使用摩尔热容。 通过对比加热和重新加热 DSC 扫描图确定所有蛋白质温度诱导去折叠的可逆性(数据未显示)。 未发现可逆性。 通过根据两态跃迁模型分析量热数据图获得去折叠温度。 使用 100 µg/ml 的抗体浓度时发现最佳信噪比(图 2)。 虽然更高的浓度不会影响去折叠温度,但高浓度蛋白质会在去折叠后发生聚合而引起强放热。
|
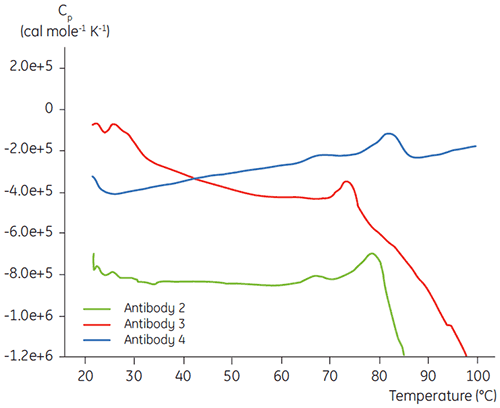
在特定抗体液体制剂研发程序的初期蛋白质表征阶段,DSC 用于将抗体的整体稳定性与其他研发中的抗体作对比。 如图 3 所示,不同抗体之间的去折叠温度有很大差别。
|
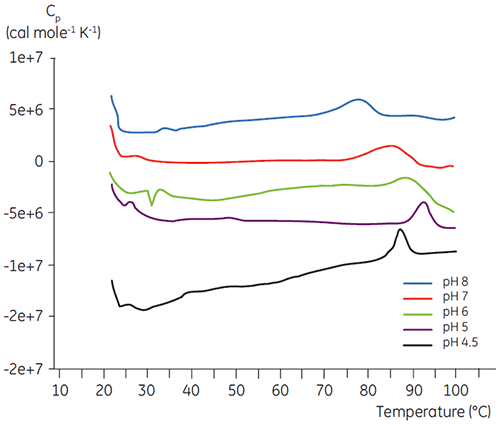
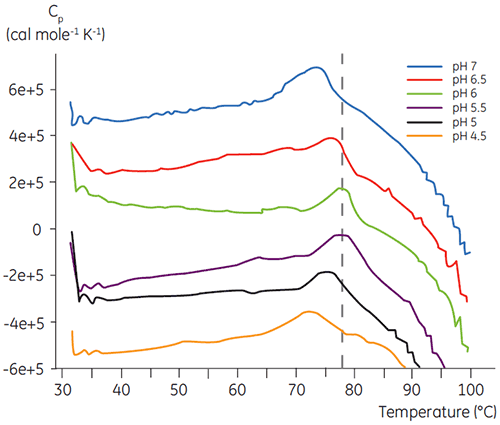
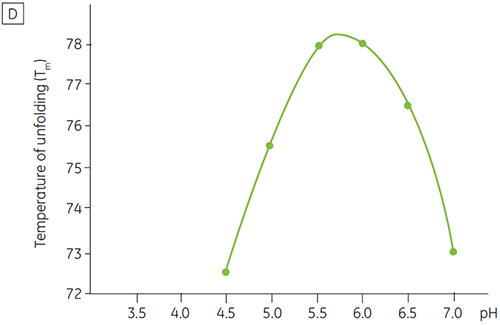
与大多数蛋白质一样,生物药剂对 pH 十分敏感,且确定最佳 pH 以尽量提高稳定性非常重要。 DSC 被证明是优化 pH 的有效工具,因为其可以在不进行两周和四周的加速稳定性研究的情况下获得数据。 虽然大多数抗体通常在 pH 为 5.5 与 6 之间时稳定性最高,但因为发现了偏差,表征最佳 pH 仍非常重要。 图 4 和 5 显示了融合蛋白质和抗体 2 的 pH 数据图。 如图所示,融合蛋白质(图 4)的最佳 pH 是 pH 5,此时 Tm 值为 92.8°C。 融合蛋白质的稳定性在 pH 值高于 pH 5 后依续下降,但对低 pH 值尤其敏感。 在 pH 为 4 时,无法观察到去折叠现象(未显示数据)。 图 5 显示了抗体的典型 pH 数据图。 在 pH 5.5 和 pH 6 条件下稳定性达到最高水平,此时 Tm 值为 78.5°C。
|
|
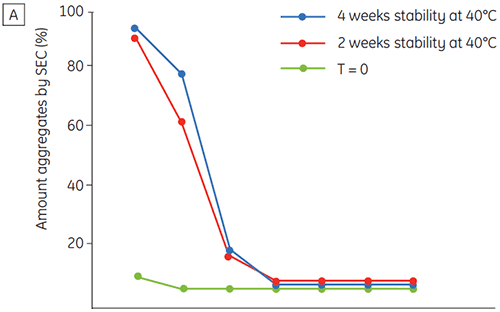
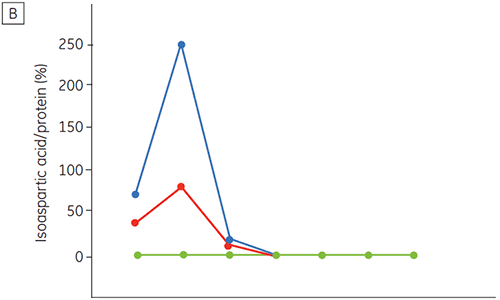
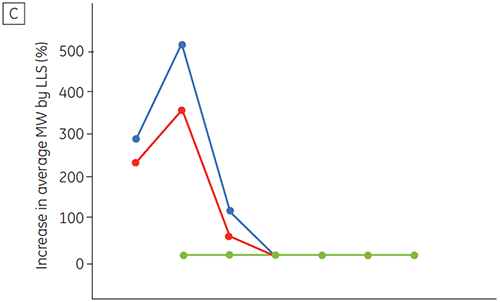
图 6 所示为时间与 pH 的函数关系,提供了抗体 2 的化学与物理稳定性数据(初期蛋白质表征阶段)。 pH 稳定性数据图研究表明,温度为 40°C 时,抗体 2 在 ≤pH 5 的条件下储存两周和四周后,稳定性出现显著变化。 DSC 只需使用新制备的样品(时间零点)就可以区别该单克隆抗体的最佳 pH 条件,与其他方法得出的结果类似(图 5)。 此外,DSC 确定 pH 值 ≥ 6.5 时稳定性开始下降,这在两周和四周时间期限的研究中并不明显,需要八周至十二周的稳定性研究才能进行说明。 换句话说,DSC 结果与本研究中使用的其他优化制剂缓冲液 pH 的方法具有很高的一致性。
|
|
|
|
DSC 的优点在于只需分析时间零点样品即可指示稳定性。 这是因为加热蛋白质由自身应力诱导。 通常,如果蛋白质的天然构象稳定,其可以比不稳定的蛋白质耐受更高程度(在更高温度下去折叠)的热应力。 所以,在使用 DSC 时,无需仅仅为了获得特定液体制剂对蛋白质稳定性的影响而在不同温度下测试样品的长期稳定性。
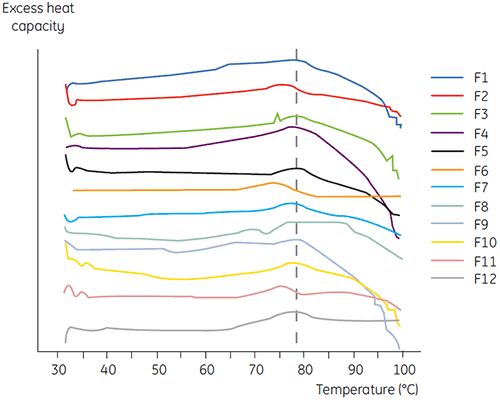
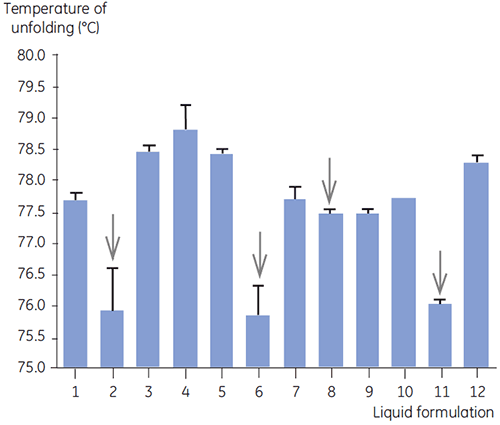
在抗体 2 的初筛过程中结合使用 DSC 和其他生物物理方法,包括 SEC、激光散射 (LLS)、毛细管电泳 (CE) 和 SDSPAGE,以选择最有潜力的液体制剂。 对样品进行加速稳定性研究,并在四周后进行分析。 实验发现,DSC 在确定对抗体 2 有负面影响的制剂方面尤其成功,但该方法还可以确定合适的液体制剂。 四个液体制剂(制剂 2、6、8 和 11)被其他分析方法认为不尽人意。通过分析时间零点样品,DSC 在初筛中将这四个液体制剂全部指认出来。 图 7 和图 8 分别显示了抗体 2 在初筛的 F1 至 F12 液体制剂中的热分析图和去折叠温度 (Tm)。 抗体 2 在制剂 F9 中的去折叠明显偏离去折叠模式。 因此它被视作关键制剂。
|
|
DSC 是蛋白质表征和制剂研发的早期过程中的一项重要技术。 使用此方法可以快速获得有关蛋白质稳定性的重要数据,这些数据可用作支持和加速液体制剂研发项目的指南。
本应用报告的作者是 Novartis Pharma AG 的 Fredrik Ollila 博士。