Malvern MicroCal iTC200 具有样品消耗量低的特点,且拥有提高生产率所需的高通量,本应用报告说明了其在从分析方法制定到先导物优化的工作流程中的应用。
药学研究的目标是调节靶标的活性,以便诱发对治疗有益的反应。 一种药物通常只有当它结合并调节其生理靶标的活性时才有效。 因此,药物研发早期的大部分工作集中在优化候选药物的靶向亲和性和选择性。
等温滴定量热法 (ITC) 广泛用于测定小分子与蛋白质之间相互作用的热力学结合参数。 同时测定结合亲和力 (KD)、化学计量 (n)、自由能 (ΔG)、焓 (ΔH) 和熵 (ΔS) 为药物研发过程中的很多阶段提供了重要信息。
以下示例说明了 MicroCal iTC200 系统提供的详细结合信息如何为药物研发的不同阶段作出贡献。
第一项研究涉及评估分析研发过程中缩氨酸结合靶蛋白。 这里的目标是进一步了解靶蛋白的结合机制和未来潜在的原料药。 此外,最终得到的数据(尤其是化学计量 (n) 和亲和力 (KD))可用于评估后续靶蛋白制剂的质量和活性。
第二个应用使用 ITC 作为在初筛后检验靶点与靶蛋白结合的正交试验法。 通过 ITC 获得的正面结果结合生物化学分析数据和通过其他生物物理方法(例如表面等离子体共振 (SPR) 和核磁共振 (NMR))获得的数据有助于准确地区分真靶点和假阳性。
最后一项研究探索了化合物的自由能在先导物优化阶段的焓与熵贡献。 同时测定结合亲和力 (KD)、化学计量 (n)、自由能 (ΔG)、焓 (ΔH) 和熵 (ΔS) 为支持先导化合物的进一步研发提供了重要信息。 焓与熵对结合能的贡献为研究潜在药物与靶标之间相互作用的方式提供了线索。 该信息可用于建立结构-活性关系和支持计算机辅助药物设计。
虽然 ITC 在一次实验中提供这些有价值的详细信息,但该技术在药物研发行业并非一直得到广泛应用,因为传统的方法需要消耗大量的蛋白质和化合物。 使用 MicroCal iTC200 可以解决这个问题。 相较于旧版的 ITC 系统,该系统的样品消耗量减少了 7 倍,且平衡时间快了 2 到 4 倍,进而提高了通量。
所有蛋白质、缩氨酸和小分子化合物都已在 Hoffmann La-Roche 内部生产。 MicroCal iTC200 仪器可从 Malvern Instruments 获得。 所有实验均在 25°C 条件下进行。
所有缓冲液在使用前均进行脱气处理。 样品池中注入 Bcl-2(30 µM 溶液),缓冲液为 pH 7.4 的 50 mM HEPES,內含 100 mM NaCl、0.5 mM TCEP 和 5% DMSO。 缩氨酸在相同缓冲液中稀释到 250 µM 的浓度。 注入量为每次 3 µl,注入时间为 6s,每次注射之间间隔 150s。 使用 MicroCal-enabled Origin™ 软件 (OriginLabs) 分析数据。
|
ITC 数据,尤其是化学计量 (n) 和亲和力常数 (KD),被用于评估蛋白质制剂的质量。
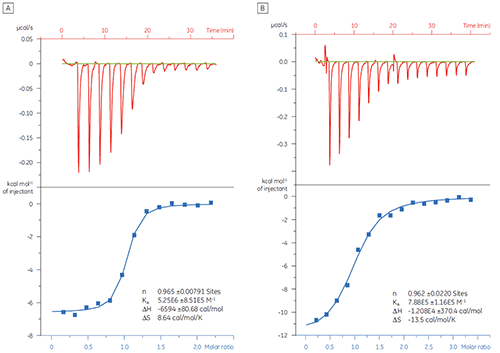
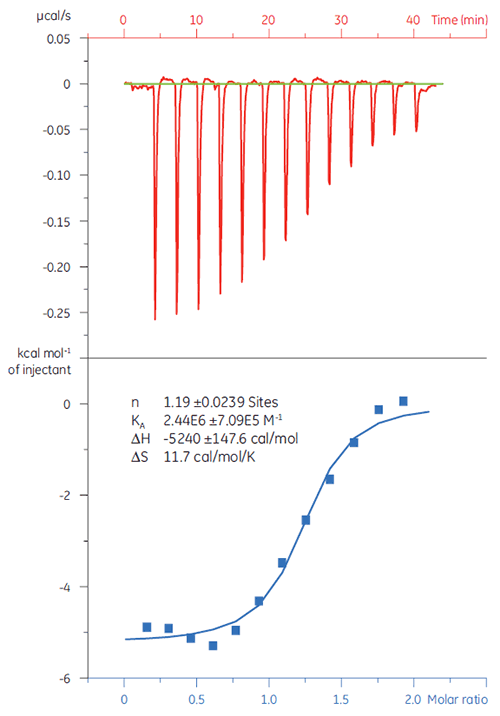
在本例中,两种不同缩氨酸与蛋白质靶标 Bcl-2(名字来源于 B 细胞淋巴瘤 2)之间的相互作用通过 MicroCal iTC200 进行研究。 图 1 显示了研究结果。 BAD 样(Bcl-2 相关死亡启动子)缩氨酸与 Bcl-2 蛋白质的结合亲和力约比 BAX(Bcl-2 相关 X 蛋白质)的结合亲和力强 6 倍。
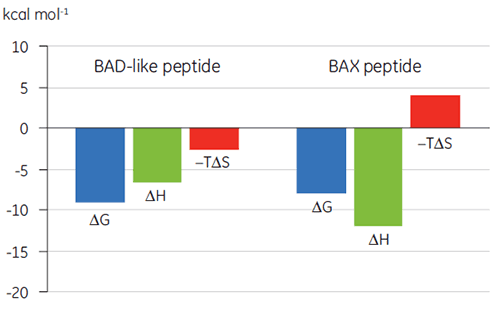
以结合标记图(图 2)的形式看热力学参数更容易发现焓和熵成分如何对整体亲和力(这里用 ΔG 代表)做出贡献。 这些图表明,BAD 样缩氨酸与 Bcl-2 的结合包含极性相互作用和疏水相互作用,而负的或有利的结合焓 (ΔH) 和熵系数 (TΔS) 证实了这一点。 如不利的熵所指示,BAX 的结合涉及更多构象改变。
|
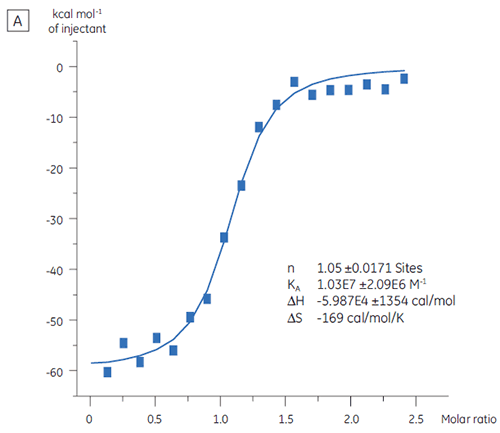
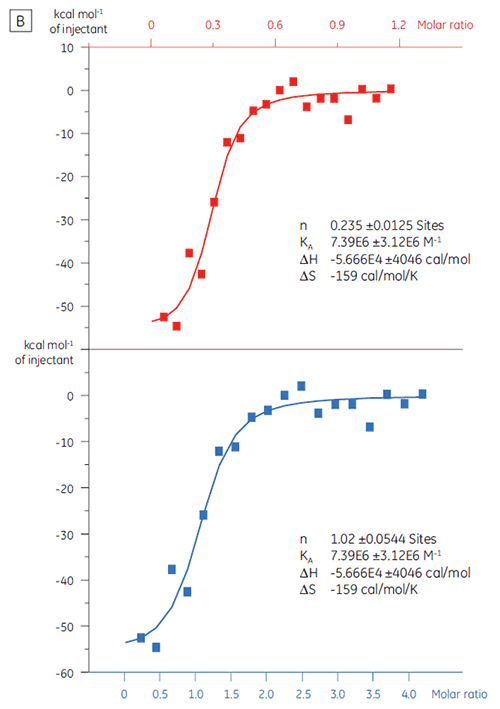
在用于筛选活动之前,靶蛋白的结合活性水平可用 ITC 來评估。 在本研究中,我们选用了一种以 97 nM 亲和力与蛋白质靶标结合的正控制缩氨酸进行滴定,对比了两批靶蛋白(图 3)。
|
|
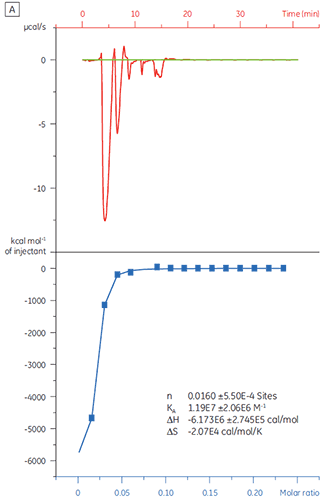
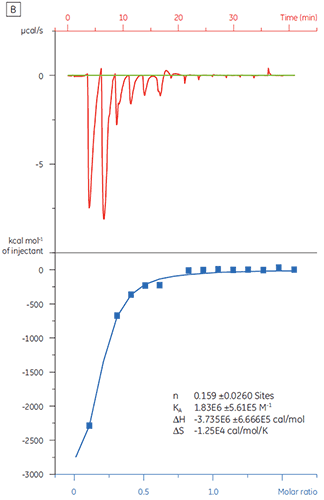
第一批,即 A 批(图 3 A)的结果显示出预期的等温线,KD 为 97 nM 且 n = 1,这指示其是具有充分活性的蛋白质。 第二批,即 B 批(图 3 B)的 KD 是 135 nM,但 n 只有 0.23,这指示蛋白质只有部分活性。 再次分析同一组数据,但将蛋白质浓度改为 2.3 µM 而非 10 µM 时,得出的 KD 值不变,而 n = 1。 这指示 B 批蛋白质中 75% 是无活性的。 B 批蛋白质被拒绝
使用于筛选活动中。
在筛选活动中较早的排除假阳性非常重要。 使用化合物 X 对靶蛋白 (TP) 20 µM 溶液进行滴定(图 4)。 KD(定义为 1/KA)确定为 4.9 µM,与使用 SPR 和 NMR 获得的研究结果一致,因此可确认化合物 X 是真靶点,并适合进一步研究。
|
当使用化合物 Y 对相同的靶蛋白进行滴定时,结果大不相同(图 5)。 在左侧,化合物 Y 用 TP 滴定。 等温线显示表观结合亲和力为 120 nM,但结合焓约比预期大 1000 倍,且化学计量值非常低 (n = 0.01)。 在右侧,相同的候选药物使用牛血清白蛋白 (BSA) 滴定。 综合分析结果指示该蛋白质具有非特异性活性。 根据这些实验,化合物 Y 被视作假阳性,不可用于进一步研究。
|
|
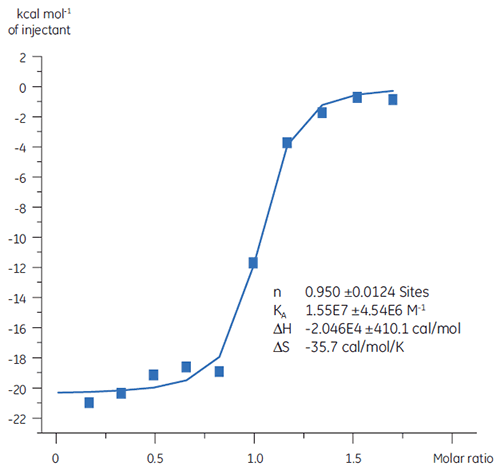
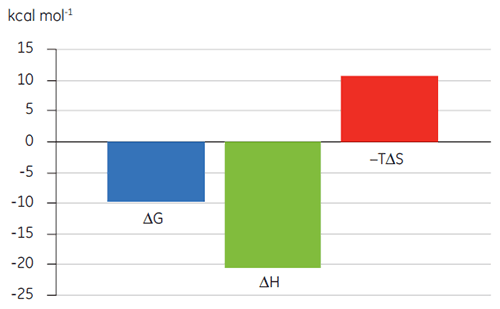
之前关于化合物 A 与 TP 结合的研究得出 KD 为 25 nM。 为了进一步表征该相互作用的热力学,我们进行了 ITC 实验(图 6)。 100 µM 的化合物 A 溶液被滴定到 10 µM 的 TP 溶液中,且 KD 值是 65 nM。 结合标记图(图 7)显示,焓相互作用强烈驱动了亲和力,但出现反熵现象。
焓相互作用通常由氢键结合和范德瓦耳斯相互作用驱动,而有利的熵结合亲和力来自于疏水相互作用。 不利的熵由相互作用的物种相对复合物的自由度整体下降导致,正如本例所示。 当两个分子相互作用时总是如此,但影响的大小表明该蛋白质经历了构象改变或该配体具有很大的柔性。 通过使用 ITC 来跟踪检测,不利熵的下降提供了一种明确的优化途经。
之前的研究表明,优化焓比优化结合熵更为困难,另外,如果仅使用这些参数中的一个进行亲和力优化会导致化合物药代动力学特性较差(亲水性过强或疏水性过强)。 综合以上分析,最好先使用焓驱动的先导物,然后再改良熵。
|
|
在使用 MicroCal iTC200 的情况下,ITC 已被应用到药物研发过程中,证明:
相关数据由美国新泽西州 纳特利 Hoffman-La Roche 的 Lin Gao 博士友情提供。