DSC 数据用于确定蛋白质工艺研发过程中抗体捕获步骤最利于稳定的洗脱条件,进而节约成本。
生物制药工艺研发可能需要大量资金,且十分耗时。 最终目标是通过最具性价比、可重复且可靠的方法实现纯化产品的产量最大化。 由于批次的失败会有着严重的经济后果,所以彻底了解包括从研究到临床研发再到商业生产的整个开发过程中蛋白的稳定性,对生物药品的商业化而言是基本的必要因素。
维持蛋白质生物药剂的稳定性并保留其活性结构直至给药是非常重要的。 通过为了解生物药剂的物理行为而设计的稳定性研究可有助于在一定程度上实现该目标。 因其复杂且微妙的结构,蛋白质通常拥有稳定性方面的问题。 为确定各种环境因素(如 pH、温度和离子强度)对直接影响蛋白质生物活性的蛋白构象完整性的影响而进行的稳定性研究是工艺研发过程中必不可少的。 这些强化分解试验通过揭露分子中的“弱点”而鉴定出关键的特征,提供了一种理性方法来确定变性机制,并通过选择适当的缓冲液、pH、离子强度和辅料从而制定有效的应对策略。
|
在制定纯化方法的同时开展稳定性研究能让科学家们设计出更为高效的方法。 在纯化工艺的研发过程中,稳定性研究能够:
稳定性研究也同样有助于制定可靠的稳定性指示分析方法。 这些数据能够帮助在标准的配方研发研究中将需要研究的条件范围最小化,从而加速药品配方的研发。 这意味着资源、成本和时间的节约。
本应用报告主要说明了差示扫描量热法 (DSC) 在指导抗体纯化工艺研发上的应用。 本报告特别描述了如何使用 DSC 的数据鉴定出蛋白质 A 捕获步骤制定过程中最佳的洗脱条件,从而在早期临床生产规模中节省了成本。
DSC 提供了监测整个处理和操作过程中蛋白质稳定性的方法。 在当处理或工艺研发过程中存在非典型的条件或蛋白质行为时,这将有利于改善条件以保护分子。
所有蛋白质的制备都是通过透析在指定缓冲液进行,或者利用 PD-10 脱盐柱 (GE Healthcare) 进行缓冲液交换。 最终蛋白质浓度约为 1 mg/ml。 利用 Malvern MicroCal VP-DSC 系统 在 5-90°C 的温度范围分析蛋白质,扫描速率为 1°C/min。 热分析图的分析是利用 Origin™ 软件在二阶或非二阶模式下开展的。
蛋白质 A 亲和层析普遍用作单克隆抗体纯化中最初的捕获步骤。 蛋白质 A 与许多免疫球蛋白 (Ig) 抗体分子的 Fc 区结合。 这种结合的特异性和选择性能够在单个步骤中产生近乎纯净的产物。 抗体分子是由细胞培养基产生的,需要从宿主细胞蛋白质、核酸和细胞培养组分中纯化而出。 无细胞条件下的细胞培养基上样到蛋白质 A 亲和层析介质中。 抗体在中性 pH (pH 7 左右)条件下与固定化蛋白质 A 结合,然后用低 pH 缓冲液(例如 pH 3.5 的柠檬酸缓冲液)洗脱下来。 洗脱后的抗体用一种具有高缓冲能力的溶液
(如 1 M pH 9 的三羟甲基氨基甲烷溶液)或通过脱盐中和。
蛋白质 A 亲和层析在应用中的一个问题是,许多抗体以及其它蛋白质在洗脱所需的低 pH 下不稳定。 如果蛋白质在低 pH 下不稳定,则可能在洗脱过程中或之后发生沉淀。
沉淀通常取决于蛋白质浓度:高浓度利于蛋白质聚合和沉淀。 因此,尽管大部分层析介质都能实现每升介质结合至少 20 g 抗体,但蛋白质在低 pH 下的稳定性成为介质上样密度的限制因素。 尽管许多抗体是 pH 敏感的,但其变性和
聚合的机制仍因蛋白质结构而异,且需要不同的缓冲液以获得最佳的稳定性。
为了改善蛋白质 A 层析工艺中的上样载量和经济性,蛋白质需要在洗脱缓冲液中进行稳定化。 DSC 可用于表征抗体由 pH 值决定的稳定性,并确定哪种添加剂能改善低 pH 条件下蛋白质的稳定性。 在 DSC 中,跃迁温度 (Tm) 的上升表明蛋白稳定性的增加。 通过稳定在低 pH 值洗脱缓冲液中的抗体,从而增加柱的上样能力,能够让蛋白质 A 层析步骤在经济上更加可行。
在这个案例分析中,客户希望改善他们抗体(X 抗体)的纯化工艺。 客户的工艺信息指示,由于高上样密度的抗体在洗脱过程中会形成沉淀,起始结合能力被限制在每升蛋白质 A 介质结合 2 g X 抗体。 为了解 pH 值对 X 抗体稳定性的影响,蛋白质在四种不同的缓冲液中制备:用 Tris 溶液调整至 pH 7.0 的柠檬酸缓冲液、pH 7.3 的磷酸缓冲液、pH 3.5 的柠檬酸缓冲液和 pH 5.0 的柠檬酸缓冲液。 根据 DSC 的数据(表 1),pH 7.0 和 7.3 条件下的 X 抗体比 pH 3.5 的抗体表现出更高的 Tm,这指示蛋白质在高 pH 条件下更为稳定。 与 pH 3.5 相比,pH 7.0 和 7.3 条件下蛋白质去折叠开始温度同样更高。 pH 5.0 时的 X 抗体与 pH 7.0 时的抗体有着相当的 Tm,而去折叠开始温度更低,表明 pH 在决定此抗体去折叠时起着重要作用。
| 主跃迁的 Tm | 去折叠开始温度 (°C) | |
|---|---|---|
| 柠檬酸-三羟甲基氨基甲烷缓冲液,pH 7.0 | 68.7 | 60.1 |
| PBS,pH 7.3 | 69.5 | 58.5 |
| 柠檬酸,pH 5.0 | 71.5 | 48.2 |
| 柠檬酸,pH 3.5 | 59.3 | 34.1 |
| 柠檬酸 + 甘露醇,pH 3.5 | 64.7 | 41.0 |
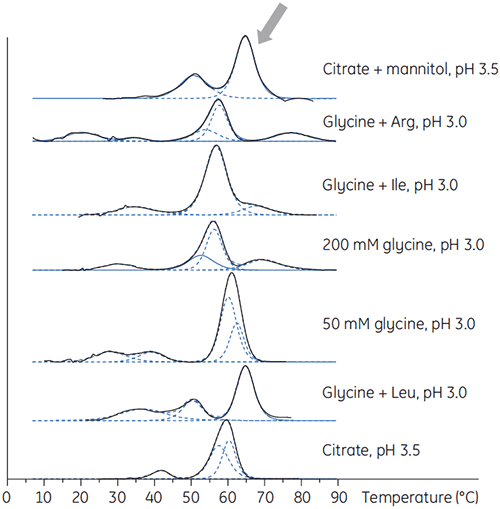
X 抗体也在含有不同添加剂的低 pH 缓冲液中制备,以确定这些添加剂中的任一种是否能在低 pH 条件下提高抗体稳定性。 开展 DSC 实验以便了解哪种条件能增加抗体的 Tm(图 2)。
|
对于 X 抗体,在 pH 3.5 的条件下柠檬酸加甘露醇系统产生了最大的 Tm 偏移,这指示最有利的稳定性。 相对于 pH 3.5 的柠檬酸而言,甘露醇的添加提高了 Tm 和去折叠开始温度 (图 3)。
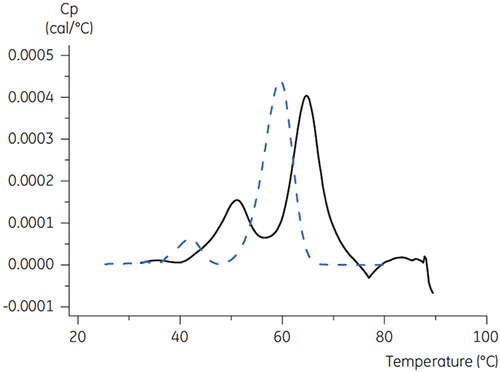
|
DSC 结果表明,在蛋白质 A 亲和介质的洗脱缓冲液中添加甘露醇将提高 X 抗体的稳定性。 洗脱过程中抗体稳定性的改善能够提高抗体在蛋白质 A 层析介质中的上样量。
利用 DSC 所确定的蛋白质稳定性信息而进行的工艺研发工作确实提高了蛋白质 A 捕获步骤中 X 抗体的上样量。 使用柠檬酸加甘露醇作为蛋白质 A 的洗脱缓冲液,使得每升蛋白质 A 介质的 X 抗体载量至少提高了 7.5 倍,达到 ≥ 15 g,而仅有柠檬酸缓冲液时只有 2 g/L。
蛋白质 A 捕获步骤后的 X 抗体也比之前工艺更为浓缩,省去了超滤/渗滤的步骤,从而节省了原料和处理时间。
在本应用报告中,DSC 数据用于确定蛋白质工艺研发过程中抗体捕获步骤最利于稳定的洗脱条件。 DSC 可在层析方法制定还没开始之前即为选择蛋白质的稳定化缓冲条件提供宝贵信息。 DSC 改善纯化工艺研发中这一关键步骤的功能,会为将来节约可观的资金。
本应用报告的作者是曾在 Diosynth Biotechnology 公司就职的 Prathima Acharya。 在此感谢纯化研发小组 (Purification Development Group) 中的 Rochelle Bazemore、Sorina Morar, Sue Cook 和 Jessica Weaver 对本研究做出的贡献。